布局TCE肿瘤疗法千亿蓝海!时迈药业能否博得市场青睐?
近日,又一创新药企正式向港交所提交上市申请。根据港交所披露,浙江时迈药业股份有限公司-B(简称:时迈药业)已递交主板上市招股书,由华泰国际担任独家保荐人。在此之前,时迈药业已于2022年成功完成3.3亿元C轮融资,投后估值达到22.3亿元,吸引了包括贝达药业、贝加投资、温氏股份、杭州高新金投、浙商证券及迈百瑞等多家知名机构的参与。
公开信息显示,时迈药业成立于2017年,作为下一代T细胞衔接器(TCE)疗法的先驱及全球领军企业,旨在利用并引导人体免疫系统对抗癌症的下一代免疫疗法,公司已开发下一代先锋疗法遮蔽型TCE,可在肿瘤中被选择性激活,用于治疗实体瘤。
时迈药业此番冲刺资本市场,正值全球TCE赛道进入高速发展期。自2024年下半年以来,该领域交易热度持续攀升,国际巨头争相加码TCE赛道。在此背景下,作为一家专注于实体瘤TCE疗法、且具备多款全球前列临床管线的企业,时迈药业的上市进程亦自然备受瞩目。
布局TCE疗法 四款创新药物处于临床阶段
智通财经APP了解到,时迈药业目前仍处于临床研发阶段,并无产品商业化。财务数据显示,2023年、2024年及2025年上半年,公司其他收入及收益分别为1464.9万元、661.8万元及227.8万元(人民币,下同)。招股书指出,时迈药业产生收益的金融资产为理财及结构性存款,各期末分别为2.16亿元、1.64亿元及6663.7万元,其中主要是结构性存款。
同期,公司亏损及全面亏损总额分别为7494.3万元、5989.9万元、2542万元,,呈现逐年收窄趋势。相应期间,公司研发费用分别为7610.9万元、5338.2万元、2238.9万元,其中员工成本是研发开支的第二大构成,2025年上半年达到259.5万元。期末,时迈药业拥有研发人员31人,上半年人均月薪约1.4万元。
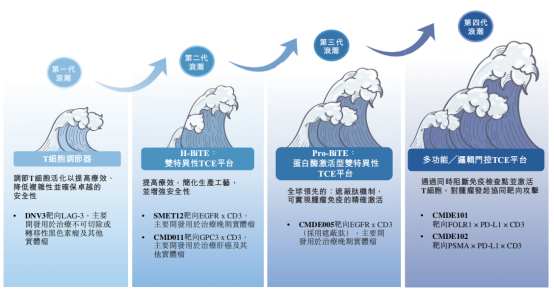
在产品管线方面,时迈药业目前拥有四款自主研发的临床阶段创新候选药物,另外还有两款处于临床前阶段的下一代多功能╱逻辑门控TCE候选药物CMDE101及CMDE102,它们分别是靶向FOLR1×PD-L1×CD3及PSMA×PD-L1×CD3的三特异性遮蔽型TCE。

其中,DNV3是一款靶向LAG3的潜在同类最佳T细胞调节器(TCM),也是时迈药业进展最快的药物,其对标的是百时美施贵宝已获批的LAG-3抗体疗法Opdualag。Opdualag于2022年获FDA批准,成为近十年来针对全新免疫检查点的首款肿瘤免疫疗法,2024年销售额达9.28亿美元,同比增长48%,显示出LAG-3靶点可观的商业化潜力。
招股书显示,临床前及临床数据表明,DNV3具有逆转对PD-1/PD-L1抑制剂耐药性的潜力。在小鼠研究中,DNV3对T细胞及B细胞的结合能力明显高于现有可比疗法(对T细胞高出20%,对B细胞高出十倍以上)。
此外,现有临床试验结果表明,DNV3与抗PD-1抗体及化疗的联合治疗于既往接受PD-(L)1抑制剂治疗的18名黏膜黑色素瘤患者中取得44.4%的客观缓解率(ORR),根据公开可得数据,高于现有可比疗法约三倍;于皮肤黑色素瘤中,IIT及II期试验数据显示,采用相同联合疗法的12名皮肤黑色素瘤患者的客观缓解率为66.7%,根据公开可得数据,高于现有可比疗法5倍以上。
公司已于2022年3月完成DNV3单药靶向治疗晚期╱转移性实体瘤及淋巴瘤的I期临床试验,目前正开展DNV3联合抗PD-1抗体及化疗的靶向治疗局部晚期不可切除或转移性黑色素瘤的II期临床试验。
根据弗若斯特沙利文的资料,截至最后实际可行日期,在治疗黑色素瘤的抗LAG-3抗体候选药物中,DNV3按临床开发阶段计在全球及中国均排名第二。目前中国尚未有抗LAG-3抗体药物获批,DNV3在此领域具备明显的先发优势。
时迈药业的另一款候选药物SMET12是一款潜在同类首创静脉注射用EGFR×CD3TCE,适应症为表皮生长因子受体(EGFR)阳性晚期实体瘤,研发进度同样领先,在全球与中国同类候选药物中临床进展排名第一。SMET12已获得美国FDA的IND批准,目前处于IIa期临床试验阶段。
此外,CMD011是一款潜在同类最佳的GPC3×CD3 TCE,CMDE005是一款潜在同类首创EGFR×CD3下一代遮蔽型TCE,二者均已获得FDA 的IND批准,并进入I期临床。CMD011在同类药物中排名全球前二,CMDE005则是中国首个且全球前二进入临床的采用遮蔽肽技术的TCE药物。
招股书显示,公司的每一款候选药物均通过专门的研发平台开发,包括多通道抗体发现平台、H型双特异性TCE平台(H-BiTE平台)、蛋白酶激活型双特异性TCE平台(Pro-BiTE平台)以及多功能╱逻辑门控TCE平台,共同构成了公司在TCE赛道中的核心竞争壁垒。
千亿美元蓝海,TCE领域升温
作为一种通过同时结合肿瘤细胞表面抗原与T细胞表面CD3分子、从而精准激活T细胞杀伤肿瘤的创新疗法,TCE兼具特异性强、可及性高、安全性好等多重优势。相比个性化、定制化的CAR-T疗法,TCE摆脱了个体化制备的高成本与复杂性;相对于抗体偶联药物(ADC),TCE则避免了化疗载荷带来的细胞毒性风险,有望成为下一代肿瘤免疫治疗的重要方向。
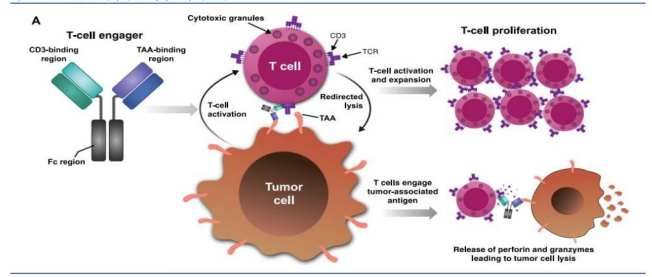
(TCE双抗原理示意图,图源招商证券)
智通财经APP了解到,近年来全球生物医药领域对T细胞衔接器(T cell-engager,TCE)的关注度显著提升,相关交易与合作持续升温。2024年以来,全球相关交易总额已突破85亿美元,安进、强生、艾伯维、默沙东、罗氏等国际巨头纷纷入局。其中,安进的CD19×CD3双抗Blincyto(贝林妥欧单抗)成为首个年销售额突破10亿美元的TCE药物,2024年销售额超过12亿美元,验证了该赛道的商业价值。
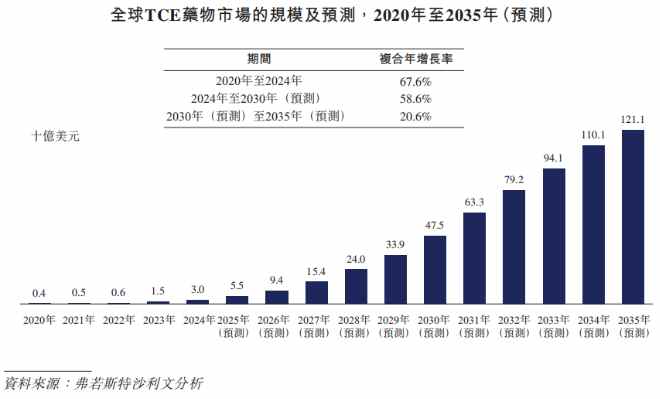
市场规模方面,全球TCE药物市场已从2020年的4亿美元快速增长至2024年的30亿美元,年复合增长率达67.6%。据预测,到2030年市场规模有望升至475亿美元,2035年进一步突破1,200亿美元,市场增长动力强劲。
然而,TCE赛道内部呈现明显的分化格局,各适应症领域“冷热不均”。与CAR-T类似,TCE的发展遵循从血液瘤向实体瘤、再向自免疾病延伸的路径。长期以来,TCE的应用主要局限于血液瘤领域,而血液瘤仅占癌症病例的不足10%,临床与市场空间相对有限;真正占据癌症90%以上的实体瘤,因存在实体瘤TAA靶向安全性、实体瘤淋巴细胞数量较少等诸多挑战,TCE研发进展缓慢。
2024年5月,安进的塔拉妥单抗被FDA加速批准用于治疗三线小细胞肺癌,也成为首款治疗实体瘤的TCE药物,一时之间风头无两,使得市场对TCE实体瘤疗法的关注度大增。
根据时迈药业招股书披露,当前仅有两款用于实体瘤的TCE药物获得全球批准,市场存在大量空白,这为具备相关布局能力的创新药企提供了结构性机遇。
以时迈药业为例,其四款临床阶段药物中,除DNV3为T细胞调节器外,SMET12、CMD011及CMDE005三款均为针对实体瘤的TCE药物,展现出明确的差异化定位。
在国内,TCE赛道参与者众多,据不完全统计,截至2025年11月,国内在研管线已超150条,但多数仍聚焦于血液瘤且处于研发早期阶段。
实体瘤领域竞争相对稀少,已有泽璟制药、康诺亚、维立志博等企业进行布局。其中,泽璟制药的三抗疗法ZG006在早期临床中展现出优于同类国际疗法的缓解率,康诺亚通过多款TCE双抗产品的对外授权实现了资产价值提前变现,维立志博则采用“血液瘤打底、实体瘤突破、自免领域卡位”的三维策略,公司的LBL-033(MUC16xCD3)是全球第二款进入临床阶段的MUC16靶向TCE双抗,聚焦卵巢癌、宫颈癌等妇科实体瘤,填补了实体瘤MUC16靶点治疗的空白。
值得关注的是,自身免疫疾病正成为TCE疗法下一个潜在的爆发点。与CAR-T相比,TCE可通过剂量调节更好控制细胞因子风暴(CRS)风险,且多数可开发为皮下给药,在长期用药安全性、便捷性与患者依从性方面具备明显优势。
数据显示,全球已有20余款TCE药物开展自免相关临床研究,靶点组合类型主要集中在 CD3×CD19、CD3×CD20、CD3×BCMA等。2024年8月,默沙东以13亿美元收购同润生物的CD3×CD19双抗CN201,体现出大药企对TCE在自免领域应用前景的认可。
整体来看,在TCE赛道潜力逐渐显现的当下,时迈药业作为一家专注于实体瘤TCE疗法的创新药企,多款核心药物具备“同类最佳”潜力,且研发进度处于全球前列,市场同类竞争者较少,具备可观的长期商业化前景。
与此同时,值得注意的是,公司产品管线均处于临床早中期,疗效与安全性有待大规模临床验证;作为一家高成长、高投入的生物医药企业,未来数年仍需持续高强度研发投入,未来现金流及融资能力或成为挑战。考虑到TCE赛道早期入场机遇,时迈药业不失为一家值得关注的投资标的。
免责声明:本页所载内容来旨在分享更多信息,不代表九方智投观点,不构成投资建议。据此操作风险自担。投资有风险、入市需谨慎。
推荐阅读
相关股票
相关板块
相关资讯

扫码下载
九方智投app

扫码关注
九方智投公众号
头条热搜
涨幅排行榜
暂无评论
赶快抢个沙发吧